
Homeopatía: son medicamentos y están legalmente autorizados

Por Gualberto Díaz y César Valera
Oímos decir una y otra vez, que los medicamentos homeopáticos no son “verdaderos” medicamentos, y que no están legalmente autorizados. Incluso acusando a la propia Agencia Española del Medicamento (AEMPS) y el Ministerio de Sanidad de “hacer la vista gorda”.
Que se diga en la calle y desde el desconocimiento nos disgusta pero no nos ofende. Que lo digan los representantes de algunas instituciones, o que lo saquen a colación en debates quienes se dicen “expertos” en el tema, sí que nos molesta y hasta nos indigna. Y, además,nos parece raro que la AEMPS no haya actuado para defender su rigor y buen hacer.
En el blog Hablando de Homeopatía ya se insertó una entrada con el manifiesto de AEFHOM (Asociación Española de Farmacéuticos HOMeópatas), que insiste en los aspectos legales y que cuenta con el apoyo del Consejo General de Colegios Oficiales de Farmacéuticos de España y de los Colegios Oficiales de Farmacia desde sus vocalías de homeopatía y plantas medicinales.
Así las cosas, la pregunta que nos habéis hecho muchas veces es: ¿Por qué estas personas se permiten decir cosas así, si no es verdad? ¿Por qué, si se puede comprobar documentalmente que son medicamentos y que están regulados como tales? Intentaremos dar una explicación de los elementos en los que intentan justificar su discurso, junto con las correspondientes aclaraciones.
Dicen que… No son medicamentos
Sí que lo son, dado que la legislación europea y la española así lo consideran. Este no es un tema debatible, son los legisladores los que lo deciden y no las sociedades científicas u otros agentes sanitarios. Es algo que puede variar entre países, de hecho hay ciertas vitaminas que se consideran suplementos en unos países y medicamentos en otros. Pero en el caso de la homeopatía, hay unanimidad: son medicamentos tanto en España como en el resto de Europa.
Esto es bueno, en nuestra opinión, tanto para los pacientes como para los profesionales: implica un mayor control y mayores garantías. Quizás los laboratorios que los fabrican venderían mucho más (con menos restricciones) si pudieran elegir salirse del marco del medicamento, pero tampoco los laboratorios pueden elegir su categoría: es la AEMPS quien lo impone al hacer cumplir la legislación actual.
Dicen que… No son “verdaderos medicamentos”
Lo dicen porque existe la posibilidad de solicitar su registro “sin indicación”, lo cual es una rareza en el mundo del medicamento. Pero no es la única rareza en esta Ley: como no todos los medicamentos son iguales, no a todos se les debe exigir exactamente lo mismo. Los homeopáticos están regulados en el apartado de “medicamentos especiales” junto con los hemoderivados, radiofármacos, gases medicinales, plantas medicinales y otros. Cada uno tiene sus características peculiares por los que cambia en algún aspecto su forma de evaluarlos, registrarlos, ponerlos en el mercado y realizar su seguimiento.
Por otro lado, aunque casi todos los medicamentos tienen al menos una indicación, no significa que sólo sean utilizados para dicha indicación. Existe el “uso fuera de ficha técnica” (off-label), que es muy frecuente sobre todo en pediatría (más del 20% de las prescripciones (Radley, ArchInternMed 2006) y más del 60% de las visitas de pediatría ambulatoria (Bazzano AT, AcadPediatr 2009). Más del 70% de estos usos no cuenta con evidencia científica que lo avale, pero eso no significa que no funcione, sino que se prescribe en base a su valiosa experiencia. Esto sucede así también en España según una tesis doctoral (Morales Carpi 2007: En el 50,7% de los casos se utilizan en condiciones distintas de las autorizadas, lo que afecta al 67,9% de los pacientes). Así que en realidad, que un medicamento se use para una indicación que no está registrada no es excepcional, ni siquiera raro, en el mundo del medicamento en general.
Por cierto, también es posible solicitar el registro de los medicamentos homeopáticos “con indicación”, siguiendo un proceso de evaluación como el de otros fármacos. Y por supuesto, hay algunos medicamentos con bastantes publicaciones que los avalan. Lo que es más, dado que ya están comercializados no sólo disponen de estudios que los comparan con placebo, sino también de estudios sobre práctica clínica real, un tipo de estudios cada vez mejor valorado por las agencias reguladoras.
Ellos dicen que todos los medicamentos homeopáticos deben rechazarse porque ninguno cuenta con “el mayor nivel de evidencia”. Lo que quiera que eso signifique, ¿por qué pedirle a los medicamentos homeopáticos algo que no cumple el 65% de los fármacos según el British Medical Journal? O puestos en el otro lado, ¿por qué no luchar primero contra ese 65% de fármacos convencionales que no sólo no ha demostrado disponer de la mejor evidencia, sino que además está produciendo daños a los pacientes por sus reacciones adversas (197.000 muertes anuales en la UE)?
Dicen que… Estuvieron autorizados de forma transitoria, pero el plazo para regularizar su situación ya se ha terminado:
Esto lo dicen algunos porque el Real Decreto (RD) de 1994 decía en su disposición adicional primera que:
A partir de la entrada en vigor del presente Real Decreto los medicamentos homeopáticos requerirán la correspondiente autorización del Ministerio de Sanidad y Consumo; y en la disposición adicional segunda que: Transcurrido el correspondiente plazo máximo para resolver el procedimiento sin que haya recaído resolución expresa, se entenderá desestimada la solicitud.
Pero parecen olvidar (¿o no han querido seguir leyendo?) que en el mismo RD, la disposición transitoria segunda añade que:
No obstante lo indicado en la disposición adicional primera los medicamentos homeopáticos que a la entrada en vigor del presente Real Decreto se encuentren disponibles en el mercado, podrán mantener su situación provisionalmente, siempre que dentro de los seis meses siguientes a la entrada en vigor de este Real Decreto se dirija al Ministerio de Sanidad y Consumo la documentación de solicitud de autorización y registro correspondiente.
Es decir, que los laboratorios farmacéuticos dispusieron de medio año para solicitar la autorización y registro de los medicamentos que, de hecho, en aquel momento ya estaban en el mercado. ¡Y así lo hicieron! Cada uno de los laboratorios tendrá el correspondiente listado y registros de entrada de los medicamentos cuya autorización solicitaron.
No hay una fecha de finalización para esta situación, que por otro lado son los propios laboratorios los que quieren que finalmente se regularice a través de una Orden Ministerial (OM) tal como está previsto. No se trata de una “carta blanca” para la homeopatía, sino de iniciar su proceso de evaluación de modo que se rechace lo que carezca de justificación; en todos los países que ya lo han hecho, de modo que hay medicamentos homeopáticos que se aceptan, y otros que se rechazan por falta de documentación suficiente.
Es decir, se trata de dar mayor seguridad a los pacientes y a los profesionales. Esto estuvo a punto de ocurrir en 2013, pero el propio colectivo de “escépticos” presionó al gobierno para que no lo hiciera. Seguro que también vosotros os preguntáis por qué un grupo que aparentemente defiende que los medicamentos se evalúen, ataca la iniciativa del gobierno de iniciar esa evaluación.
Queremos apostillar que, de todos modos, el RD vigente es el de 2007, que en el segundo punto de su disposición transitoria sexta indica que:
Los titulares de medicamentos afectados por la disposición transitoria segunda del Real Decreto 2208/1994, de 16 de noviembre, deberán comunicar a la Agencia Española de Medicamentos y Productos Sanitarios su intención de adecuarse al presente real decreto. La comunicación deberá producirse en el plazo de tres meses desde la entrada en vigor de la orden por la que el Ministerio de Sanidad y Consumo determinará los requisitos mínimos y procedimiento para la comunicación, debiéndose abonar la tasa prevista en el apartado 3.7 del artículo 111 de la Ley 29/2006, de 26 de julio. Transcurrido dicho plazo, los medicamentos acogidos a la Disposición transitoria segunda del Real Decreto 2208/1994, de 16 de noviembre, para los que no se hubiera comunicado su intención de adecuarse, conforme a lo establecido en este apartado, no podrán ser comercializados, debiendo ser retirados del mercado.
Pues eso, que estamos esperando a que el nuevo gobierno publique la OM que concede 3 meses a los laboratorios para comunicar para qué medicamentos quieren solicitar la evaluación y registro. Las estimaciones del sector hablan de una reducción drástica en el número de medicamentos para los que se presentarán dosieres actualizados, lo cual sin duda es bueno en el sentido de que serán los más fiables y los que disponen de dosieres más completos a día de hoy.
*Actualización de mayo 2019: El 27 de abril de 2018 se aprobó por fin la Orden Ministerial que retoma el proceso de registro definitivo de los medicamentos homeopáticos. El 30 de octubre se publicó el listado de los 2008 medicamentos que solicitaban acogerse a este trámite, y que se actualizó a 2014 en Enero de 2019. El calendario de evaluación para el registro o desestimación de cada medicamento (en realidad, para grupo de medicamentos fabricados a partir de la misma cepa de partida) se alarga hasta el 2022. Los medicamentos que no se han acogido al trámite han quedado automáticamente fuera del mercado. Más información en: HomeopatiaSuma – Legislación
Además, los laboratorios han podido solicitar para cada uno de sus medicamentos el registro por la vía simplificada (sin reclamar indicación terapéutica) o bien solicitando una indicación de la que poder hacer publicidad (12 medicamentos han solicitado esta modalidad). Más información en: ¿Cómo es que sólo 12 medicamentos homeopáticos tienen efecto terapéutico?
Dicen que… Si están autorizados, ¿por qué no aparecen en el buscador de la AEMPS?
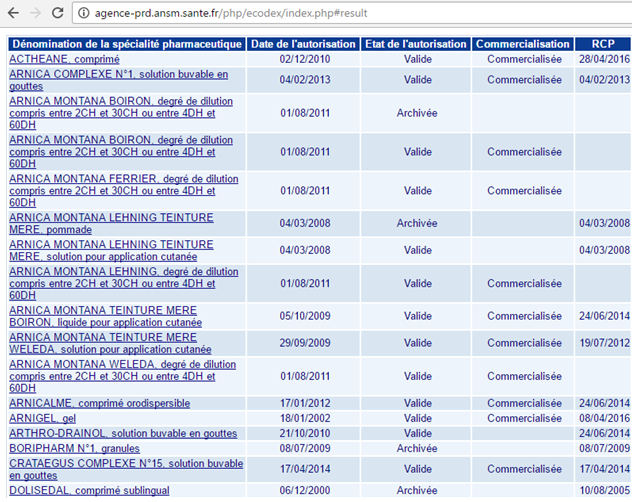
Porque ese buscador sólo contiene los medicamentos evaluados y registrados, y los medicamentos homeopáticos aún no lo están en España, aunque sí están autorizados. Sí que están evaluados y registrados por ejemplo en Francia, lo cual se puede comprobar desde su buscador; adjuntamos para ejemplo los medicamentos homeopáticos que contienen Arnica Montana.
Hay que aclarar que sí que aparecen 12 medicamentos homeopáticos en la base de datos española, de los cuales 5 mantienen la autorización y para 7 ha sido revocada. Todos ellos se han elaborado a partir de Lycopodium en diferentes diluciones, y creemos que hoy día ninguno de ellos se comercializa por ese laboratorio. Sólo podemos pensar que se trató de una prueba piloto de uno de los laboratorios homeopáticos, para comprobar las condiciones en las que la AEMPS registraría los medicamentos homeopáticos por una vía diferente de la que permitirá la OM pendiente de aprobación.
Dicen que… ¿Cómo es posible que se permita que existan medicamentos homeopáticos aparentemente absurdos como “Muro de Berlín”?
Pues existen porque hay laboratorios que los fabrican y terapeutas que se han planteado utilizarlos. La verdad es que nosotros no los hemos estudiado ni los hemos empleado jamás, y tampoco hemos hablado de ellos en los cursos que impartimos. Además, dudamos mucho que en España estén autorizados. En cualquier caso, su utilización desde la “metáfora” (para los que se sienten encerrados) y sin ninguna documentación que lo avale, estaría muy lejos de la homeopatía clínica e injustificada desde nuestro punto de vista (que comparten la mayoría de nuestros colegas médicos y farmacéuticos).
Así que, en todo caso, es un motivo más para defender el desarrollo de la regulación, tanto de los medicamentos como del ejercicio profesional.
*Actualización de mayo 2019: Hemos decidido profundizar un poco en esta cuestión, con una nueva entrada: Qué hacer con el Muro de Berlín en Homeopatía
Dicen que… ¿Por qué en EEUU se quiere que estos medicamentos avisen de que están basados en teorías del siglo XVIII no fundamentadas científicamente?
Quien lo dice no es la agencia norteamericana del medicamento (FDA), sino la de comercio (FTC), que por cierto no tiene competencias sobre el tema. Seguro que la FDA, que sí es experta en medicamentos y que está trabajando con los homeópatas sobre la regulación de la homeopatía, entenderá que es tan absurdo como obligar a un antibiótico a indicar que está basado en teorías del siglo XIX (cuando se desarrollaron las teorías “modernas” de los microbios), sin tener en cuenta los avances que se han producido desde entonces.
Las bases científicas de la homeopatía lo son porque se discuten por científicos y en los foros científicos (universidades y revistas científicas), y si se discuten es porque son científicas: precisamente cuando no hay discusión, es cuando se habla de dogmas o creencias.
Entonces,si …
- está claro que son medicamentos,
- están autorizados legalmente y dicha autorización está vigente,
- tanto médicos como farmacéuticos y laboratorios están de acuerdo en someterlos a evaluación para su registro definitivo,
- en España su utilización ocurre a través del médico o el farmacéutico de modo que el interés del paciente quede salvaguardado, y
- cada vez más pacientes perciben que les ayudan y los demandan,
¿Cuál es el problema? Pues cuando hacemos esa pregunta a los escépticos en diferentes foros, responden que la homeopatía “es imposible”, y lo dicen sin explicarnos por qué rechazan la documentación científica que les presentamos. De A. Einstein para unos y de T.A. Edison para otros, esta cita nos parece apropiada:
“Los que dicen que es imposible no deberían molestar a los que lo están haciendo”
Gualberto Díaz Sáez. Médico.
Entre otras cosas, especialista en homeopatía, responsable de investigación en la Asamblea Nacional de Homeopatía (ANH) y en el Grupo de Trabajo de Homeopatía de SEMERGEN.
César Valera Arnanz. Farmacéutico.
Entre otras cosas, especialista en homeopatía, presidente de AEFHOM y vocal de plantas medicinales del Colegio de Farmacéuticos de Madrid.
20 Comments
Deja un comentario

También te puede interesar
Oportunidad de doctorado con financiación completa en Brasil.
Ha surgido una oportunidad para una beca de doctorado Cotutelle totalmente financiada para explorar el uso de la homeopatía en...
5ª Conferencia HRI: “Investigación de vanguardia en homeopatía” Del 16 al 18 de junio – Londres
Los días 16, 17 y 18 de junio tendrá lugar la 5ª Conferencia Internacional de Investigación del Instituto de Investigación...




Gualberto, César,
¡excelente!… muy bien argumentado, claro y preciso… Pero ya sabéis lo de los prejuicios y los átomos, así que nosotros a lo nuestro, a seguir haciendo y explicando…
un fuerte abrazo
Pues sí, como decía Einstein “es más fácil desintegrar un átomo que un prejuicio”.
Con un poco de suerte, aunque este post no sirva para desintegrar prejucios ya formados, quizás prevenga la formación de prejuicios nuevos 😉
Ojalá sea así! Un abrazo Gonzalo
Gualberto
He leído esos argumentos de parte de Fernando Frías Sánchez y el blog naukas, siempre repiten lo mismo. ¿Por qué no se le denuncia a Frías?
Si no hay una ofensa o amenaza personal, no creemos que la denuncia sea el canal adecuado: hay que informar a las personas (sobre todo a las que necesitan ayuda) y darles la información, la confianza y la seguridad que necesitan.
Por otro lado, aunque el escepticismo extremo e irrespetuoso (pseudoescepticismo, negacionismo…) nos llega a molestar y le hemos dedicado algunas entradas en este blog, lo cierto es que ha permitido que muchísima gente que no conocía la homeopatía ahora la conozca.
Gente que siente curiosidad al observar tanto debate (eso demuestra que es un tema interesante y de actualidad) en las redes sociales y en los medios de comunicación, y al profundizar descubre testimonios muy favorables de otros pacientes y médicos ofreciendo datos científicos y explicaciones modernas.
Ya ves, nos han regalado un trampolín desde el cual dar a conocer la homeopatía, y con el tiempo todas esas personas van accediendo a más información, ofrecida por médicos (y farmacéuticos) en un lenguaje sereno y desde nuestro compromiso con la salud y con el rigor. En comparación con el lenguaje alarmista y la superficialidad de los escépticos, esas personas optan por probar este abordaje integral y bien tolerado, y ya sabemos que no hay nada como experimentar uno mismo el resultado.
Así que no nos pongamos nerviosos. Eso sí, esforcémonos en difundir la información correcta que tanto los profesionales como los pacientes necesitan.
Saludos,
Gualberto
Muchas gracias por todas estas explicaciones. Soy un seguidor del grupo Facebook que se llama Podemos Terapias Naturales, y cuando pongo algún artículo de Homeopatía, recibo las críticas en este artículo descritas.
Gracias a ti, Manuel, por seguirnos.
Precisamente por lo que dices es por lo que hemos optado por el formato pregunta-respuesta: son siempre las mismas críticas, a menudo realizadas en un tono burlón y repetidas por las mismas personas a las que ya hemos respondido extensamente en otras ocasiones.
Ya que ellos no parecen dispuestos a entender, nos ha parecido bueno que blogueros como tú dispongáis de una entrada como esta a la que poder enlazar para responder, en lugar de tener que buscar y elaborar una información que es relativamente compleja si uno no está familiarizado.
Espero que te sea útil en este sentido, un abrazo
Gualberto
Cuanta falta hacía una información como esta, rigurosa y veraz, sobre el medicamento homeopático. Esperemos que aclare conceptos a algunos opinadores desinformados.
Gracias amigos.
Gracias, Guillermo.
A veces nos resistimos a ser demasiado exhaustivos en la información quedamos, sobre todo si es de tipo técnico, para no aburrir.
Pero habiendose difundido tanta información incorrecta, ha sido necesario extenderse!
Saludos,
Gualberto
Creo que se puede hacer un recurso al ombudsman de las instituciones europeas si existen leyes más ‘evolucionadas’ en otros países de la unión.. Paso tu texto a una amiga más experta que yo! (una medicina que no hace daño tendría que ser declarada de interés público 🙂 ) un saludo Fabienne
Desconozco todo eso de lo que hablas, pero parece muy interesante.
Por favor, no dejes de darnos novedades a través de la página de contacto.
Muchísimas gracias por colaborar con la homeopatía… es decir, con los pacientes!
Abrazos
Comparto de verdad todos los contenidos.
Saludos desde Caracas-Venezuela
Muchas gracias!
Un abrazo
excelente info.una ,manera de mantener vivo la homeopatia y defenderla es estar unidos e informados
Gracias, esa es la idea de este blog.
Información “amable” y contrastada para que todos podamos servirnos mejor de esta estupenda opción terapéutica.
Para actualizar la INFO: este pasado 25 de septiembre de 2017 ha sido revocada la autorización de los 5 compuestos homeopáticos que quedaban en el mercado. Así que ya no hay NINGUNO autorizado en España.
El tratamiento homeopático ha de ser totalmente personalizado, tanto la sustancia como la dosis, la forma de administración, etc depende de cada persona, es algo individualizado y en función de las necesidades de cada persona… ¿por qué entonces se venden en cajas de X comprimidos, todas iguales, hechas en serie en un proceso industrial?
Los compuestos homeopáticos —por ley— no precisan demostrar su efectividad para ser autorizados, basta con que demuestren que son inocuos. No tiene más controles ni análisis que las juanolas de regaliz.
Y ahora al meollo… hay que demostrar que lo similar cura lo similar, no hay un solo estudio que demuestre esta simplicidad. Si ingerir 100g de cianuro te mata y no tomar cianuro te deja vivo… está claro que ingerir 0,0000000000000000001g de cianuro estará más cerca de dejarte vivo que matarte, pero hasta ahí, no hay ningún proceso desconocido de por medio más que «echar menos».
Las sucusiones (lo que los demás llamamos agitar) ya no se hacen sobre un ejemplar de la Biblia tal y como hacía Hahnemann, ¿han probado si es igual de eficaz dinamizar sobre una Biblia que sobre un Corán o no dinamizar?
Me gustaría que me recomendase lo más simple que hay en medicina, de eficacia inmediata, demostrada y no reproducible mediante placebo, así ya nos cercioramos de que la homeopatía funciona al menos en algún caso… ¿me puede recetar un anestésico homeopático que sea efectivo y elimine el dolor al 100%, pongamos, para sacar una muela, o anestesia general para operar a corazón abierto? ¿y un anticonceptivo… sí, una píldora para no quedar embarazada? y si fallase… ¿una pastilla «del día después»?
Pero lo realmente importante es que describan el funcionamiento de estos compuestos… Boiron mismo no sabe cómo funcionan, y eso que los fabrica. Hoy en día no sale un medicamento al mercado sin que se conozca toda la cadena de reacciones bioquímicas que producen su resultado. Por cierto, el decir que se explica por física cuántica es como no decir nada, porque la física cuántica no habla de eso. Tampoco me vale la «memoria del agua», ni en las pastillas homeopáticas —que no contienen agua— ni en gotas… el agua también tiene un dipolo magnético pero no se puede imantar, la «memoria del agua» con los medicamentos tiene la misma duración que la estructura y forma que guarda el agua cuando mete su dedo en un vaso y lo vuelve a sacar… ¿ve cuánto tiempo recuerda el agua su dedo y mantiene su forma?… son nanosegundos.
La homeopatía no tiene explicación sobre cómo podría funcionar, de hecho no ha demostrado su funcionamiento, no tiene ni un solo artículo autorizado en España, es incapaz de justificar sus principios (lo similar cura lo similar, dar golpes con una biblia… ), no ha erradicado ninguna enfermedad, no hay un simple anestésico, habla de la estructura del agua cuando esta dura lo que tarda el agua en olvidar el dedo que sacamos, sus composiciones no llevan agua, las que lo llevan… ¿de dónde sacan agua sin memoria?
En fin, una risa.
No, lo que es de risa son tus comentarios. Por ejemplo:
1. “hay que demostrar que lo similar cura lo similar, no hay un solo estudio que demuestre esta simplicidad.”
El ese “no hay un solo” resulta que existen decenas de estudios. Así que tu mentira se termina. https://www.ncbi.nlm.nih.gov/pubmed/20558607
2. “las sucusiones (lo que los demás llamamos agitar) ya no se hacen sobre un ejemplar de la Biblia tal y como hacía Hahnemann, ¿han probado si es igual de eficaz dinamizar sobre una Biblia que sobre un Corán o no dinamizar?”
No tiene relevancia la biblia, Hahnemann la ocupaba no por ser una biblia en sí, sino por el grosor de la misma. Igual podría haber empleado otro libro más grueso.
3. “Me gustaría que me recomendase lo más simple que hay en medicina, de eficacia inmediata, demostrada y no reproducible mediante placebo, así ya nos cercioramos de que la homeopatía funciona al menos en algún caso…”
Hay cientos de estudios que prueba eficacia frente al placebo, y es facíl encontrarlos, ¿o te los pongo como en el ejemplo del punto 1?
4. “¿me puede recetar un anestésico homeopático que sea efectivo y elimine el dolor al 100%, pongamos, para sacar una muela, o anestesia general para operar a corazón abierto?”
Curioso, ningún fármaco elimina el dolor al 100%. Tu ignorancia en estadística es brutal.
5. “¿y un anticonceptivo… sí, una píldora para no quedar embarazada? y si fallase… ¿una pastilla «del día después»?”
Ese “argumento” tuyo no tiene sentido, ¿en dónde quedó la individualización? Y en caso de que no fuera así, un anticonceptivo busca bloquear ciertas funciones específicas (no siempre funcionan bien), la homeopatía en altas potencias no podría hacer eso (afortundamente).
6. “Por cierto, el decir que se explica por física cuántica es como no decir nada, porque la física cuántica no habla de eso. Tampoco me vale la «memoria del agua», ni en las pastillas homeopáticas —que no contienen agua— ni en gotas… el agua también tiene un dipolo magnético pero no se puede imantar, la «memoria del agua» con los medicamentos tiene la misma duración que la estructura y forma que guarda el agua cuando mete su dedo en un vaso y lo vuelve a sacar… ¿ve cuánto tiempo recuerda el agua su dedo y mantiene su forma?… son nanosegundos.”
Bueno, es tu opinión contra la demostración matemático de Allan Widom. Y el argumento de los “nanosegundos” está superado y sólo aplica para experimentos con difracción de Rayos X que no son adecuados para obtener mediciones indirectas de la composición de distintos tipos de agua.
shttp://onlinelibrary.wiley.com/doi/10.1002/qua.22140/abstract
7. “La homeopatía no tiene explicación sobre cómo podría funcionar, de hecho no ha demostrado su funcionamiento, no tiene ni un solo artículo autorizado en España, es incapaz de justificar sus principios (lo similar cura lo similar, dar golpes con una biblia… ), no ha erradicado ninguna enfermedad, no hay un simple anestésico, habla de la estructura del agua cuando esta dura lo que tarda el agua en olvidar el dedo que sacamos, sus composiciones no llevan agua, las que lo llevan… ¿de dónde sacan agua sin memoria?”
Todo lo que te has aventado es un vulgar muñeco de paja. Para que lo entiendas, tus mentiras no tienen sentido, ergo no tienes credibilidad. Y bueno, con relación a tu pregunta de que no llevan agua, eso pasa para algunas “preparaciones”, pero en todo caso tu argumento támpoco tiene sentido: https://www.ncbi.nlm.nih.gov/pubmed/24439454
Gracias por tus aportaciones,
Soy muy consciente del enorme esfuerzo que supone ir buscando las publicaciones y los enlaces que permiten aclarar con rigor y contundencia, lo que con pasmosa frivolidad se anda escribiendo por ahí.
Un saludo
Gualberto
Gracias Manolo por tomarte las molestias de escribir un comentario tan exhaustivo y darnos la oportunidad de responder cada una de estas dudas, que con frecuencia expresan algunos detractores de la homeopatía y que resultan a todos de gran interés.
En primer lugar, gracias por actualizar la información sobre la situación del registro de algunas de las diluciones de Lycopodium del laboratorio DHU que aún estaban vigentes. En cambio, debo volver a explicar que los medicamentos homeopáticos están autorizados en España de varias maneras:
1.Registro por una vía centralizada europea, como fueron estos medicamentos a base de Lycopodium;
2.Nuevo registro nacional por la vía simplificada sin indicación;
3.Nuevo registro nacional por la vía de reconocimiento de indicación terapéutica;
4.Autorización de comercialización a través de la disposición del Real Decreto 2208 de 1994 y posterior RD 1345 de 2007, pendientes de evaluación y registro conforme a la Orden Ministerial aún pendiente de aprobación por el ministerio. Es esta la manera en la que la mayoría de homeopáticos están autorizados en España, y tal como explico en el post no aparecen en la base de datos de la AEMPS (CIMA) porque no tienen número de registro. En cambio, lo tienen en los países de nuestro entorno y España debería resolver este retraso.
El tratamiento homeopático PUEDE ser personalizado, pero no siempre es necesario y prueba de ello es que en las farmacias encontramos medicamentos a base de Árnica para los golpes, o jarabes con fórmulas compuestas para la tos, y así un largo etcétera. Sin embargo, cuando esta opción falla o para problemas en los que no tenemos una solución estándar o cuando se trata de un problema crónico, obtendremos mejores respuestas terapéuticas a través de la personalización. Personalización es escoger un medicamento que puede ser útil para diferentes problemas del mismo paciente y que encajan con un perfil, pero no hay tantos medicamentos (o perfiles) como pacientes, eso sería una locura. La elección de la dilución y la pauta depende de reglas establecidas y varía según la intensidad de los síntomas y la manera en la que el paciente encaja con el perfil. Cada paciente necesitará, en cualquier caso, una caja con un número de dosis disponible. Es probable que a veces tenga que comprar otra caja y otras que sobre, como ocurre con cualquier otro medicamento.
Los medicamentos homeopáticos precisan demostrar su inocuidad para poder acceder al registro simplificado. Es normal que si un medicamento no presenta problemas de seguridad, se pueda acelerar su aprobación; con otros tipos de medicamentos, desde vacunas a quimioterápicos, también hay mecanismos de autorización acelerada por diferentes motivos. Por lo demás, los medicamentos homeopáticos tienen que demostrar su utilidad, para lo cual deben presentar documentación adaptada a su naturaleza, mucho más exhaustiva cuando el registro no es simplificado sino que reclama una indicación terapéutica (que eventualmente le permitiría, por ejemplo, hacer publicidad).
Además, debo aclarar que los controles y análisis son muy diferentes de los productos alimentarios y siguen los mismos requerimientos que el resto de medicamentos, bajo el control de las agencias de medicamentos de los países en los cuales se distribuyen. Las materias primas y productos intermedios pasan por controles de laboratorio para comprobar que la concentración de sus principios activos no está por encima ni por debajo de los límites establecidos para cada producto según las farmacopeas oficialmente reconocidas.
Lo similar no siempre cura lo similar; lo correcto es que con frecuencia las sustancias que resultan tóxicas en altas dosis, en dosis bajas pueden estimular reacciones de adaptación que ayudan al organismo a recuperar su equilibrio (homeostasis). Es un fenómeno estudiado por la farmacología paradójica (un ejemplo) y la hormesis (a través de diferentes mecanismos de acción), y se conoce perfectamente en la farmacología convencional incluyendo los molestos efectos rebote. Explicaciones más extensas pueden encontrarse en esta publicación. Tan sólo hablando de fármacos convencionales, podemos encontrar que la metformina es oxidativa pero tiene un efecto final antioxidante, un ejemplo entre muchos.
Las sucusiones, que en efecto son agitaciones realizadas de una manera específica, son cruciales en la fabricación de principios activos homeopáticos y deben realizarse de una manera determinada que no incluye textos religiosos y no tiene nada que ver con ello. Cuando el proceso se hacía de manera manual, se sugería que se usaran “golpes enérgicos a una superficie elástica”, y un libro encuadernado en cuero pudo ser una buena opción artesanal en la época. Tratar de darle un significado religioso a través de piruetas dialécticas es inapropiado y a veces malintencionado, le ruego que no se haga eco de ello. Hoy en día, de todos modos, se usan aparatos cuya calibración se revisa periódicamente y se supervisa en las inspecciones periódicas que realizan las autoridades sanitaras. Y de hecho los estudios sí demuestran diferencias entre dinamizar y no hacerlo; si no las hubiera sería ridículo seriar las diluciones con la carga de trabajo que ello conlleva (y el consiguiente incremento de los costes de fabricación y del precio final).
Proponer que le proporcione un anestésico o un anticonceptivo homeopático es tan improcedente como pedir un antibiótico o un antiinflamatorio que sea anestésico o anticonceptivo. Además, como se ha explicado la homeopatía pone en marcha reacciones de reparación, y esos son ejemplos de todo lo contrario porque en situaciones como éstas nos interesa anular la capacidad del organismo para hacer su función. En cambio, se pueden proponer tratamientos para problemas derivados del uso de este tipo de tratamientos de modo que se acelere la recuperación de las funciones inhibidas.
No es muy científico preguntar por el mecanismo de acción de “la homeopatía” como no lo sería preguntar por el de los “antibióticos”, ya que cada uno tiene el suyo. Ciertamente, se conoce el mecanismo de acción de numerosos medicamentos homeopáticos en determinadas indicaciones. Por otro lado, quisiera corregir su impresión de que sólo se comercializan medicamentos con mecanismos de acción conocido: son muchos los medicamentos para los que no se conoce, empezando por el popular paracetamol y siguiendo por el metrotexato (en artritis reumatoide) o la azatioprina, por poner un par de ejemplos más conocidos. Además, y aunque no tiene que ver con los mecanismos de acción descritos, la estructura del agua puede modificarse de forma estable si persisten cantidades residuales de las sustancias de partida, como es el caso dado que la presencia de nanopartículas ya se ha demostrado abundantemente. Los experimentos que demuestran una estructura físico-química específica se han realizado tanto con diluciones como con gránulos impregnados (proyecto DYNHOM, con Cuprum y Gelsemium). Es evidente que un agua que ha perdido dichas partículas y estructuras (por ejemplo tras evaporarse) no puede retener modificaciones previas (“memoria” como usted dice). Los fenómenos cuánticos, a mi entender no se conocen lo suficiente como para poder justificar con ellos la acción de la homeopatía, aunque creo probable que en un futuro nos ayuden a entender no sólo la homeopatía, sino otros muchos fenómenos de la farmacología y de la biomedicina que aún no acertamos a explicar.
Es decir, que:
• la homeopatía actúa sobre los mecanismos de regulación del organismo,
• el mecanismo de acción de algunos medicamentos homeopáticos es conocido,
• los medicamentos están debidamente autorizados y por eso…
• se dispensan en las farmacias (y sólo en farmacias),
• sus principios se explican por modelos farmacológicos que aplican tanto a sustancias convencionales como homeopáticas (curvas dosis-respuesta en “U” o en “J”, liberación de nanopartículas sobre las que se forman clatratos y otras metaestructuras),
• demuestra eficacia en ensayos clínicos,
• aún más importante demuestra efectividad y utilidad en condiciones reales de aplicación, y debo añadir que además…
• responde a las expectativas y valores de muchos pacientes y profesionales cuya libertad de elección debe respetarse (y ejercerse con una información suficiente y sin que suponga pérdidas de oportunidad terapéutica).
En fin, una gran oportunidad.
Me estoy cabriendo…
Tanta tontería sobre una manera de curar “la Homeoàtía”… Me licencié en 1987 y ya en el año después con un gran esfuerzo económico… 4.000 Pesetas por curso, estaba matriculándome en BOIRon, DURANTE UN FIN DE SEMANA AL MES PARA APRENDER Y PODER EJECUTAR LA HOMEOPATÍA que a mí a muchos de mis pacientes alemanes “ayudó” – y además al ser alemanes, ya tenían el conocimiento de esta terapia, que por cierto en Alemania y en Francia entra en la “SS”, es decir es gratuita.
Después de haber ejercido más de 30 años de medicina, he de afirmar que todos que atacan esta forma de terápía, o es por “ignorancia o envidia”.
Desde luego hay que ser flexible y saber
-Cuando la Homeopatía es la forma correcta de actuar
y – desistir: sobre todo no meterse en terrenos “peligrosos
– es decir, saber discernir entre una inflamación simple u OTRO TERRENO, que pide más análisis antes de ser tratada.
Un Homeopata no es Dios: y lo sabe
Primum no noccere…
Saber distinguir entre síntomas e ir al fondo. Para esto existen los Análisis clínicos, RX, RMC, TACS
y especialistas.
…la Ignorancia es atrevida. Por favor, que siempre sea un médico que “RECETE y ANALICE – sin jamás poner la vida del paciente en peligro. (<para ello hemos jurado el JURAMIENTO HIPOCRÁTICO) Y NO
SE HABLA MÁS.
¡VALE!
Heidi Schuler, col. 24866
Gracias Heidi por tu testimonio.
Nuestra experiencia como médicos debe ser contada, así como nuestra forma de practicar la homeopatía sin prometer lo que no es posible y sin descartar otros medios que puedan ayudar a nuestros pacientes.
Un saludo afectuoso